|
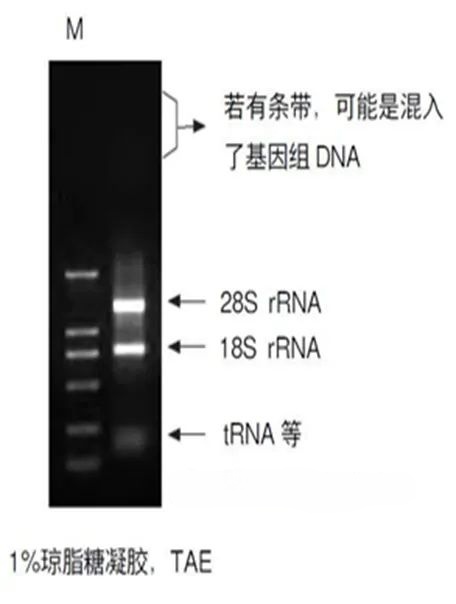
qPCR技术介绍(二)——RNA提取&逆转录RNA操作的注意 RNA模板的质量 RNA的纯度会影响cDNA的合成量,所以在提取RNA后需要进行RNA纯度和质量检测。 吸光度测定方法 OD260/OD280(R)体现了RNA中的蛋白质等有机物的污染程度,质量较好的RNA的R值应在1.8~2.0之间。当R<1.8时,溶液中的蛋白质等有机物的污染比较明显;当R>2.2时,说明RNA已经被水解成了单核苷酸。 在对核酸进行吸光度检测时,需要注意稀释液应使用TE Buffer。 根据OD260,可以计算提取的RNA浓度: RNA浓度 (µg/µL) = (A260-A320)×稀释倍数×0.04 凝胶电泳方法 利用1%的琼脂糖凝胶(含溴乙锭)电泳结果,对提取的Total RNA进行RNA完整性以及是否有基因组DNA污染的评价。 如果可以清晰观察到两条rRNA条带(真核生物:28S和18S;原核生物:23S和16S),且其浓度比值大约为2:1,则RNA未降解。 若观察到smear现象,则RNA已发生降解。 如果观察到大于28S或23S的条带,则样品可能有基因组DNA污染,这时可以考虑使用DNase I处理。
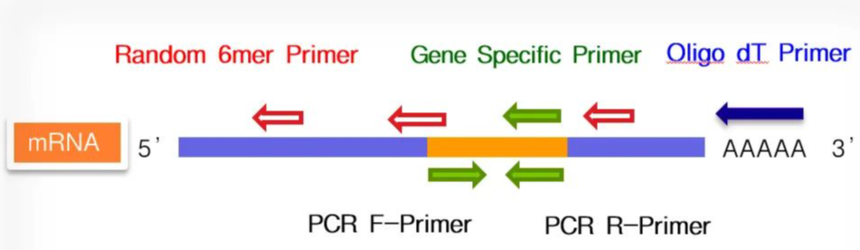
逆转录引物的选择
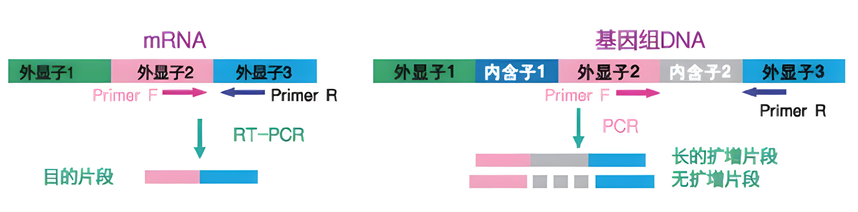
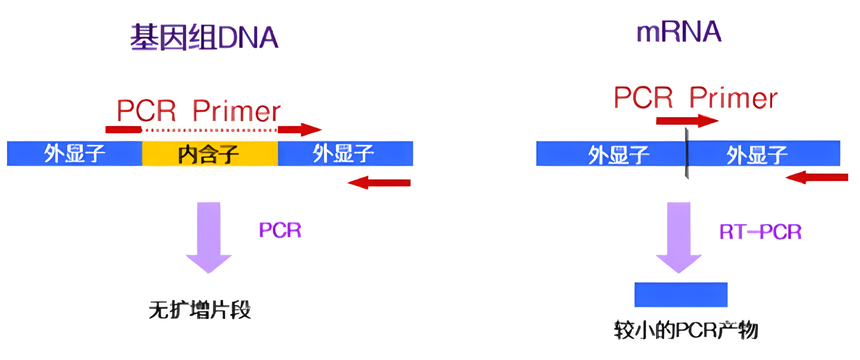
Random Primer Oligo dT Primer Gene Specific Primer 利用Real Time RT-PCR进行基因表达解析时,将Random Primer和Oligo dT Primer混合使用效果更佳,不仅可以在mRNA全长范围内高效率逆转录,还可以将mRNA二级结构及mRNA分解的影响控制在最小限度。 RNA模板中混入基因组DNA的处理 首先确认目的基因的基因组结构,选择跨越较长的内含子。然后,在这个内含子两侧的外显子上分别设计上、下游引物。 Real Time PCR反应时通常扩增的目的DNA片段长度都比较短,设置的条件也是适合短片段DNA的扩增,超过500 bp就很难扩增了。所以,当内含子足够长时,基因组DNA来源的扩增就不能发生。
当内含子较短时,可将其中一条引物设计在exon junction上,这样,基因组DNA来源的扩增也不能发生。但是,此种方法不适合具有单个外显子的基因、或者不具有内含子的生物种以及基因组情报没被解析的生物种等。
使用常规方法提取Total RNA后,再使用DNase I 分解混入的基因组DNA,最后进行苯酚/氯仿抽提、乙醇沉淀等纯化Total RNA。或者使用能去除基因组DNA的逆转录试剂进行逆转录反应。亿目思明星产品All-in-one RT SuperMix( gDNA Removal) (Code No. 20123)是可以除去基因组DNA的定量PCR专用逆转录试剂,试剂盒中附带gDNA Removal,逆转录的同时去除基因组DNA。 |