近年来,以CRISPR/Cas为代表的基因编辑带来了生物技术革命性的进步,分别在2015和2017年两次被Science评为年度突破性科学进展之首,获评Nature近10年最具影响力的五大科学事件之首和2020年诺贝尔化学奖。短短几年时间,CRISPR技术成为科研界的热门内容,被称为下一代分子诊断技术!
1987年,CRISPR 位点在细菌基因组中被发现,2002年CRISPR相关蛋白被发现,随后证实CRISPR-Cas系统是一种RNA引导的适应性免疫系统,可以抵御病毒、质粒等入侵遗传元素,其免疫过程大致可以分为三个阶段:适应、表达和干扰。
(1)适应阶段Cas蛋白识别并捕获外来核酸片段,获取新间隔序列,并整合插入自身CRISPR阵列,形成免疫记忆。
(2)表达阶段当外来核酸再次入侵时,从CRISPR阵列中相对应的间隔序列,转录出CRISPRRNA(crRNA)前体并加工获得小的、成熟的crRNA,其中包含一个保守的重复序列和一个间隔序列,crRNA进一步与一个或多个Cas蛋白相互作用,形成RN(ribonucleoprotein)复合体。
(3)干扰阶段Cas-crRNA复合体识别外来核酸,通过crRNA靶向目标核酸区域,介导Cas蛋白特异性地破坏入侵核酸。
CRISPR/Cas可分为二大类群:第1类以多个Cas组成的效应复合体行使功能为特征,包括Ⅰ、Ⅲ和Ⅳ型;第2类则只需单个多结构域的Cas,包括Ⅱ(Cas9)、Ⅴ(Cas12)和Ⅵ(Cas13)型。第2类系统简单、高效、操作方便,是目前主要的基因编辑系统,其中最具代表性的是Cas9。
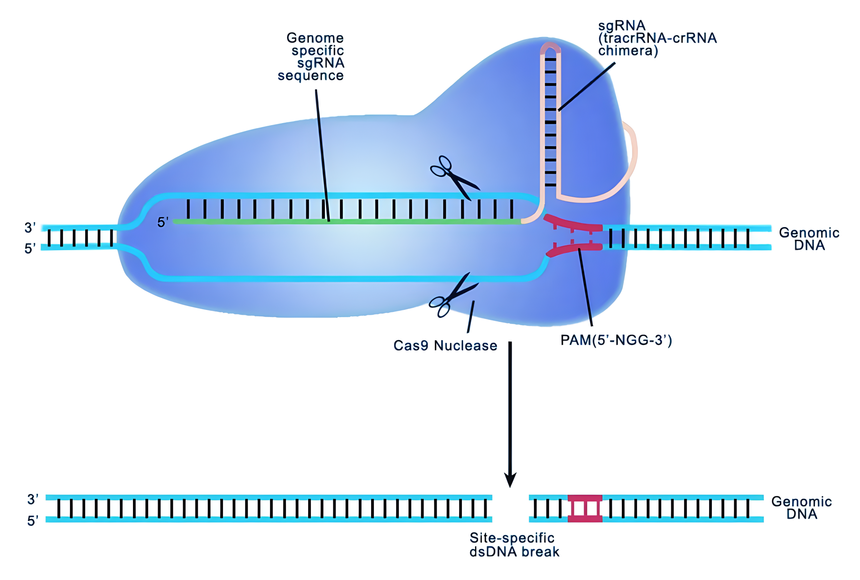
Cas9编辑基因原理
相比Cas9,Cas12a和Cas13a仅需crRNA 即可实现特异性靶位点切割,这表明其系统更为简洁,具有成为精度更高、安全性更好的新一代基因编辑工具的潜力。
广泛应用于核酸检测的三种Cas12a蛋白包括LbCas12a、AsCas12a和FnCas12a,其中LbCas12a的反式切割活性最强。2017年Jennifer Doudna团队开发了DETECTR(DNA endonuclease-targeted CRISPR trans reporter)检测技术,利用LbCas12a(Lachnospiraceae bacterium ND2006)与crRNA复合物,并在crRNA引导下利用RuvC结构域切割PAM(TTTN)序列下游18~25nt的靶DNA,在识别并切割靶标dsDNA的同时,激发Cas12a的反式切割活性,切割反应体系中的ssDNA报告分子。ssDNA报告分子标记有荧光基团和猝灭基团,一旦切割,荧光基团和猝灭基团被分离,就会产生稳定而强烈的荧光信号,荧光信号的强度可以指示检 测样本中靶标的量。此外,DETECTR还与重组酶聚合酶等温扩增技术结合(recombinase polymerase amplification,RPA),不仅提高了检测分析的灵敏度(amol/L水平),而且避免了对复杂、昂贵设备的需求。该技术现已成功应用于人乳头状瘤病毒(human papilloma virus,HPV)和SARS-CoV-2的检测。

DETECTR检测方法原理图
2018年王金、赵国屏团队建立了HOLMES(one-hour lowcost multipurpose highly efficient system)检测技术,联合LbCas12a与PCR扩增,可以在1 h内完成对伪狂犬病毒(pseudorabies virus,PRV)和日本脑炎病毒(Japanese encephalitis virus,JEV)的检测,灵敏度可以达到1~10 amol/L,此外还可以准确区分病毒基因型以及人类的单核苷酸多态性 。但是,该技术联合PCR扩增提高稳定性的同时也增加了检测时间和设备依赖性。
来源于嗜热菌的Cas12b含有单个RuvC结构域,脱靶效应低且同样具有反式切割活性。CRISPRCas12b是双RNA引导的DNA核酸内切酶系统,可以识别和切割靶向dsDNA或ssDNA,也可以非特异性切割ssDNA。当靶向dsDNA时,Cas12b依靠PAM序列(TTC或TAC)完成顺式切割。当靶向ssDNA时,Cas12b可不依赖PAM序列实现切割,而且切割活性高于dsDNA。
根据这些特性,王金、赵国屏团队建立了升级版的HOLMESv2,将AacCas12b(Alicyclobacillus acidoterrestris)蛋白与环介导等温扩增(loopmediated isothermal amplification,LAMP)结合,只有含有5ʹ-TTC-3ʹ的dsDNA或切割后具有的5ʹ-TAC-3ʹ的DNA序列才能激活AacCas12b反式切割活性,该技术实现了DNA、RNA特异性检测以及区分SNP和定量DNA甲基化。
2019年,Dai等开发了基于CRISPR-Cas12a的E-CRISPR检测技术,通过CRISPR-Cas系统来影响电信号输出,利用Cas12a的反式切割活性获得高传导信号。该检测技术将修饰有3′-亚甲基蓝(3′-MB)标签的ssDNA报告分子固定于金电极上,在靶DNA存在的情况下,Cas12a-crRNA反式切割MB-ssDNA分子,亚甲基蓝标签的分离,会使电化学信号降低。在没有靶标DNA存在时,Cas12a的反式切割活性保持沉默,ssDNA分子保留在电极表面,从而导致亚甲基蓝的高电化学电流。

SHERLOCK检测方法原理
2020年,Ding等开发了AIOD CRISPR(all-in-one dual CRISPR-Cas12a)检测技术,将RPA扩增和CRISPR检测的所有反应组分混合,在引入两个crRNA的同时,添加高浓度ssDNA报告分子,一步即可完成对SARS-CoV-2和HIV-1的检测。
Cas13是RNA引导和RNA靶向的核酸酶,具有两个HEPN结构域,特异性作用于RNA靶标。2017年,张峰团队开发了SHERLOCK(specific high-sensitivity enzymatic reporter unlocking)核酸检测技术。该技术与DETECTR原理相同,但依赖于LwaCas13a(Leptotirichia wadei)核酸酶的活性,识别和切割靶标RNA的同时,反式切割ssDNA报告分子产生荧光信号。
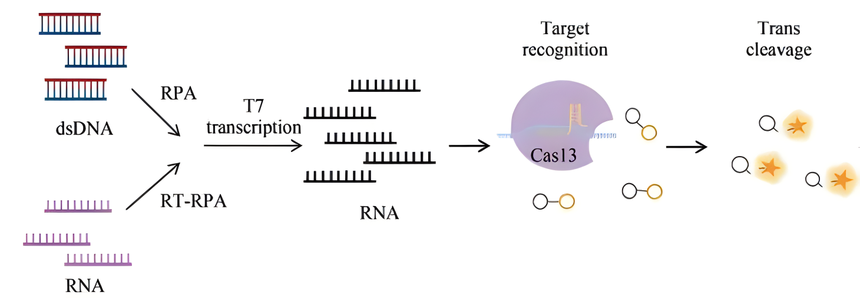
SHERLOCK检测方法原理
为了解决定量的问题,该团队开发了SHERLOCKv2,将4种类型的Cas蛋白(LwaCas13a、PsmCas13b、CcaCas13b和AsCas12a)组合使用,切割用不同的荧光基团标记的报告分子,在FAM、Cy5、HEX和TEX通道中进行检测,实现了定量同时检测4种核酸序列。SHERLOCKv2也被应用于侧向流动分析,通过金纳米颗粒标记的抗FAM抗体,在试纸条上检测被切割的报告分子,产生视觉比色信号。

SHERLOCKv2 检测结果读取方式
2020年,ACKERMAN等联合CRISPR诊断和微流控技术开发了CARMEN(combinatorial arrayed reactions for multiplexed evaluation of nucleic acids)检测平台,该技术可以同时检测8个样本,169种人类相关病毒。但由于芯片定制成本高和检验操作流程复制,很难应用于临床。该团队在CARMENv.1的基础上开发了mCARMEN(microfluidic combinatorial arrayed reactions for multiplexed evaluation of nucleic acids),将CRISPR诊断、微阵列技术与简化的临床工作流程相结合,开发的mCARMEN呼吸道病毒检测面板,可同时检测21种呼吸道病毒,包括SARS-CoV-2及其他冠状病毒、流感病毒等。

CARMEN-Cas13检测方法原理
Arizti-Sanz团队将扩增与CRISPR-Cas13系统检测整合为一步诊断平台SHIN(streamlined highlight of infection to navigate pandemic),通过添加RNase H提高核酸检测灵敏度,并采用管内荧光和配套的智能手机应用程序,实现了SARS-CoV-2有效的核酸检测。SHINE诊断平台最大限度地减少了对设备的要求,也减少了结果读数偏差。
除了Cas12和Cas13系统外,结构紧凑的Cas14蛋白也具有类似的反式切割活性。Cas14是一种靶向ssDNA的CRISPR内切酶,与CRISPRCas12相比,Cas14识别和切割目标核酸序列不受PAM序列的限制,而且对crRNA与靶标模板之间的核苷酸错配的容忍性更低,内部序列对核苷酸错配更敏感,这一特性使Cas14能够实现高保真的区分SNP。基于此特性建立的Cas14a-DETECTR检测平台,已应用于人类HERC2基因SNP分型。

CRISPR/Cas14a分子检测示意图
发展至目前,基于CRISPR的核酸检测技术具有以下优点:
(1)高特异性,可实现单核苷酸点突变检测;
(2)高灵敏性,可实现单拷贝核酸检测;
(3)快速性,整个检测在0.5–1.0h内完成;
(4)简便性,不需专业设备及人员,可现场完成;
(5)试剂耐受冷冻干燥,便于储存和携带;
(6)易开发性,可快速开发出新核酸检测试剂盒等。
随着进一步的改进和优化,其更具通用性,CRISPR核酸检测技术将成为POCT的最优选。
已报道的多种基于 CRISPR 的分子检测技术比较

第一,是新的Cas蛋白的开发及突变体的筛选鉴定。例如后来发现的Cas14蛋白,不同于Cas12和Cas13,其擅长识别单链DNA,丰富了CRISPR工具箱。而具有不同切割特性的Cas蛋白的筛选鉴定为提高检测通量及降低“脱靶效应”提供了方法。
第二,是将CRISPR/Cas其和其他的技术平台结合起来,开发新颖实用的生物传感策略。比如将Cas9蛋白固定于石墨烯场效应晶体管,以及将Cas系统的报告探针固定于电极上,从而实现不需要使用信号扩增的电化学生物传感器的构建。使用水凝胶作为其响应原件实现多样化的信号输出。与微流体技术结合开发出的CARMAN技术,可以对数十个样本,上百种病毒进行快速检测,为解决通量低的问题提供了方法等。









