|
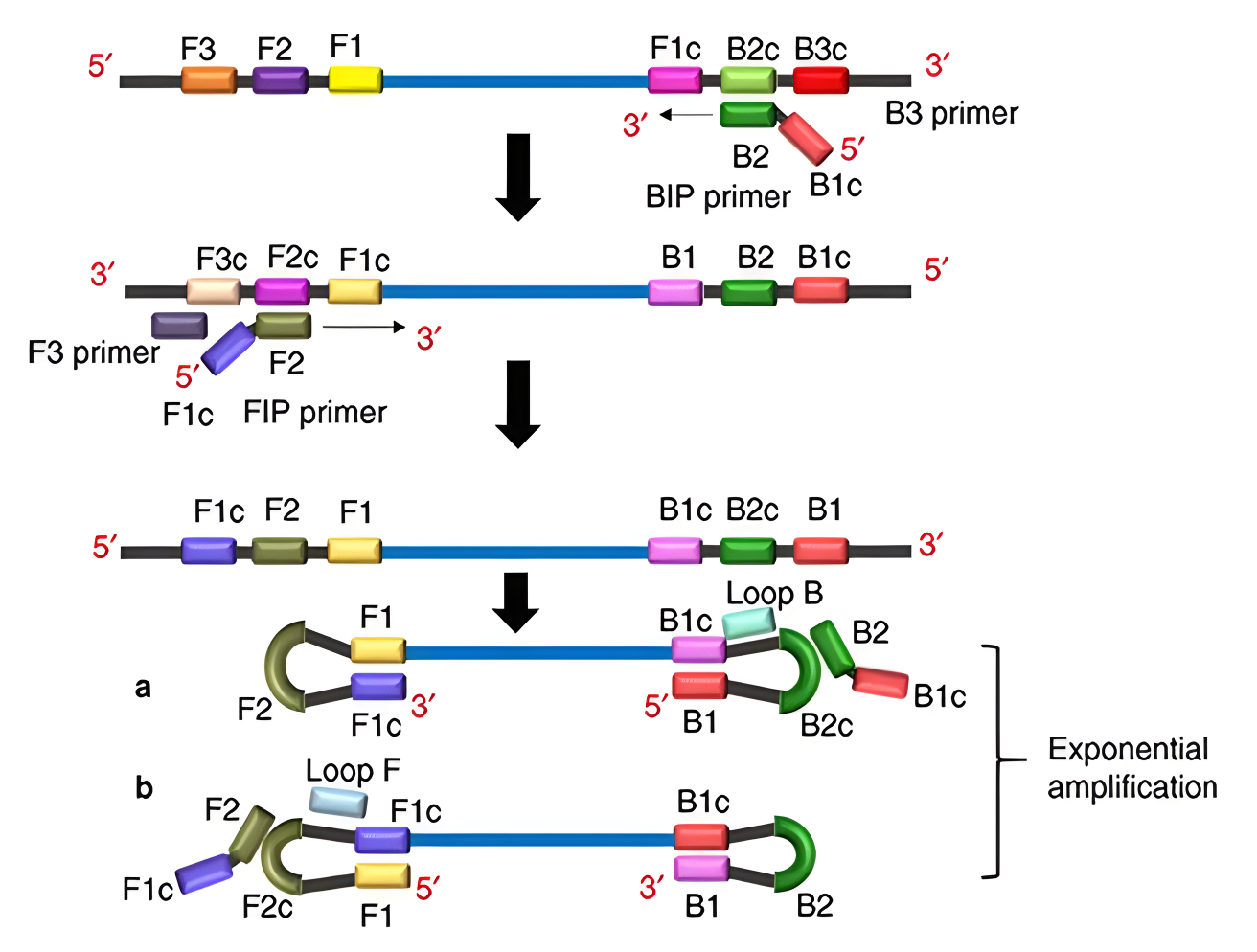
分子诊断之七大主流等温扩增技术原理及应用01 环介导等温扩增(LAMP):由日本荣研株式会社Notomi等于2000年首先提出。其原理主要是基于靶基因3'和5'端的6个区域设计4种特异引物,包括1对外引物(F3和B3)、1对环状引物(LF和LB)和1对内引物(FIP和BIP),在链置换DNA聚合酶(Bst DNA polymerase)的作用下,60-65℃恒温扩增,15-60分钟左右即可实现109-1010倍的核酸扩增。 LAMP反应过程主要分为三个阶段: 1. 复制起始阶段:双链DNA在65°C条件下处于动态平衡稳定状态,上游内部引物FIP与释放的单链DNA模板结合,启动DNA的合成,在DNA聚合酶链置换活性作用下,合成一条与模板DNA序列互补的DNA链。上游外部引物F3比FIP短几个碱基且浓度较低,它缓慢地与目标DNA中的F3c互补配对,启动链置换DNA合成,最终再次形成双链模板DNA,释放FIP连接的互补链,其5’端F1c与F1区域互补形成颈环结构。FIP连接的互补链作为模板供下游内部引物BIP结合并启动DNA合成,继而下游外部引物B3与B3c区互补结合,在链置换DNA聚合酶的作用下引导双链DNA的合成,并释放BIP引导合成的哑铃状互补链,该链即为LAMP反应进入循环扩增阶段的起始材料。 2. 循环扩增阶段:哑铃状DNA链通过F1区3’端自身引导的DNA合成迅速转化为颈环结构。FIP与茎环状DNA的单链区F2c结合,开始链置换合成,解离出之前的合成链,这条释放的单链DNA由于3’端存在B1c和B1互补区,从而也会形成颈环状结构,继而以该链3’端B1区作为起始位点,继续引导以自身为模板的DNA合成,并释放之前FIP引导合成的互补链。此次释放的单链DNA由于两端分别存在F1-F1c和B1-B1c两个互补区,因此形成哑铃状结构,恰好是之前的翻转结构。类似于从哑铃状结构到后续结构的过程,哑铃状结构迅速以3’末端的B1区段为起点,以自身为模板合成DNA,进而BIP与B2c区结合,引导链置换DNA合成,释放之前由B1引导合成的DNA链,随后产生相似的结构以及哑铃状DNA,由此形成循环扩增。 3. 延伸阶段:由颈环状DNA为模板,BIP与单链B2c区结合,启动链置换DNA合成,形成颈环DNA,继而以其3’端B1区为起始位点,引导以自身为模板的链置换DNA合成,产生长短不一的2条新茎环状结构的DNA。BIP引物上的B2与颈环DNA杂交,启动新一轮扩增,且产物DNA长度增加一倍。扩增的最后产物是具有不同个数茎环结构、多环花椰菜样结构的DNA的混合物,且产物DNA为扩增靶序列的交替反向重复序列。 在反应体系中添加环状引物LF和LB,它们可以跟哑铃状结构5’端的环状区(位于B1和B2之间,或者F1和F2之间)进行结合,从而增加DNA合成的起始位点,可明显增加LAMP扩增的效率,缩短反应时间。 LAMP反应原理示意图(来源:网络) LAMP技术的优点包括: 灵敏度高:比传统的PCR方法高2-5个数量级,扩增模板极限仅为几个拷贝。 反应时间短:30-60分钟就能完成反应,添加环状引物后可在20-30分钟检测到扩增产物。 特异性强:采用4条引物,识别靶基因的6个位点,保证扩增的特异性。 操作简单:不需要进行双链DNA的预变性,在一管内即可完成全部检测。 费用低:不需要昂贵的精密仪器和特殊试剂。 检测方便:在核酸大量合成时,产生副产物焦磷酸镁沉淀,有极高的特异性。只要用肉眼观察或浊度仪检测沉淀浊度就能够判断扩增与否,也可使用荧光染料进行检测。 可扩增RNA模板:反应体系中加入逆转录酶,即可一步实现RNA的高效扩增。 LAMP方法也存在一些缺点,如引物设计要求比较高;灵敏度高,一旦开盖容易形成气溶胶污染,可能导致假阳性问题等。 交叉引物扩增技术(CPA):由优思达公司于2008年独立研发成功,也是中国首个具有自主知识产权的核酸扩增技术。 该技术针对目的基因的4或5个区域设计4或5条特异性引物,利用具有链置换特性的Bst DNA聚合酶、甜菜碱,在63℃左右条件下进行高效、快速、高特异地扩增靶序列。 根据交叉引物数量的不同,CPA可分为双交叉扩增和单交叉扩增。双交叉引物扩增使用两条交叉引物和两条剥离引物,两条交叉引物分别与模板链互补结合后延伸,随后剥离引物在Bst DNA聚合酶的作用下将新合成的单链剥离,最后两条交叉引物在Bst DNA聚合酶的作用下以新生单链为模板合成大量目的片段。
CPA双交叉原理示意图(来源:doi:10.1038/srep00246) 单交叉引物扩增则使用一条交叉引物、两条剥离引物和两条普通引物。首先交叉引物与模板链结合并延伸为双链,而剥离引物在Bst DNA聚合酶的作用下将新链与模板分离;随后普通引物以新链为模板,合成两条不同长度的单链DNA;最后以这两条单链为模板,以交叉引物与普通引物为引物对,形成扩增循环。
CPA单交叉原理示意图(来源:doi:10.1038/srep00246) CPA技术具有以下优点:
其缺点主要包括:
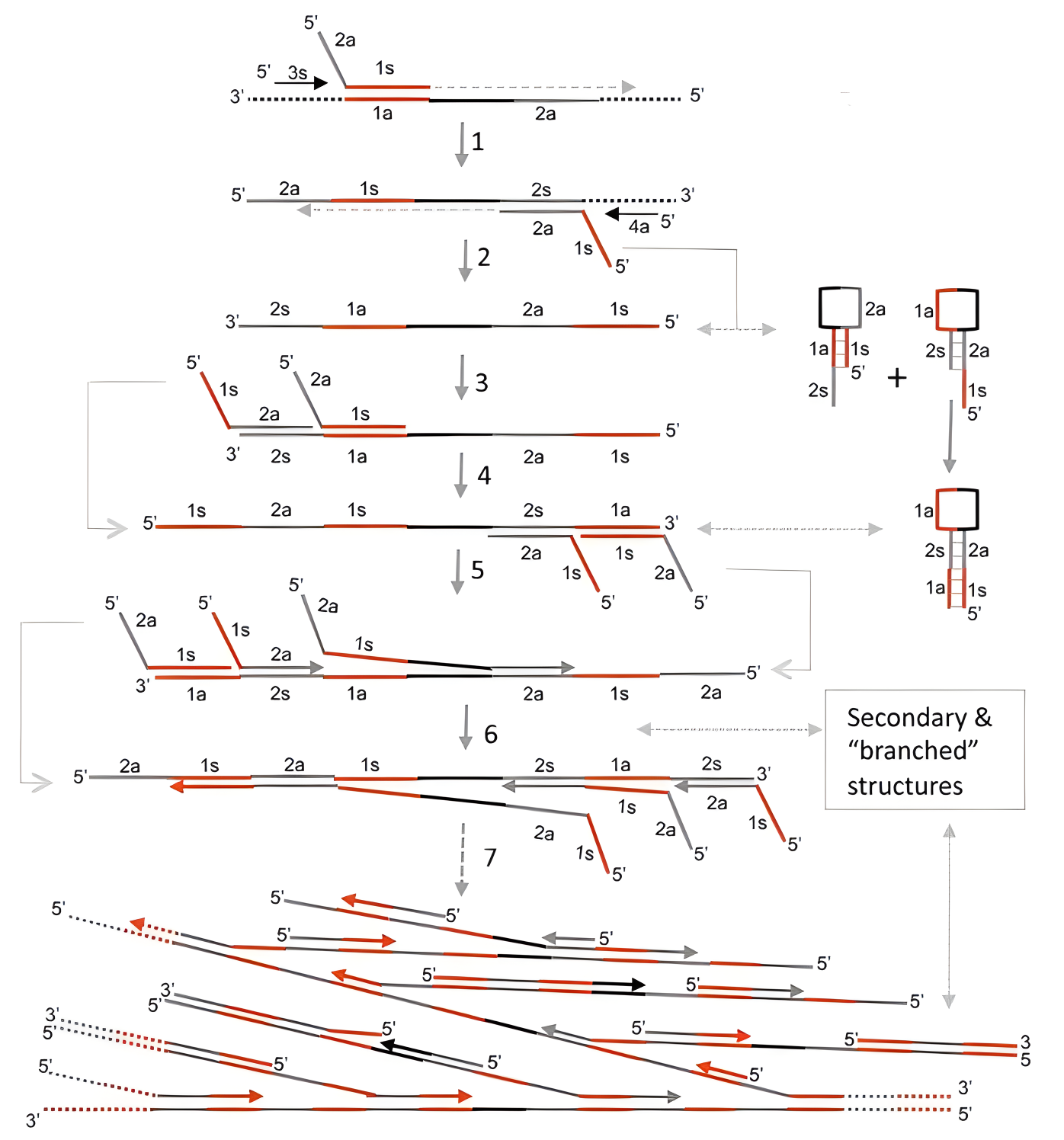
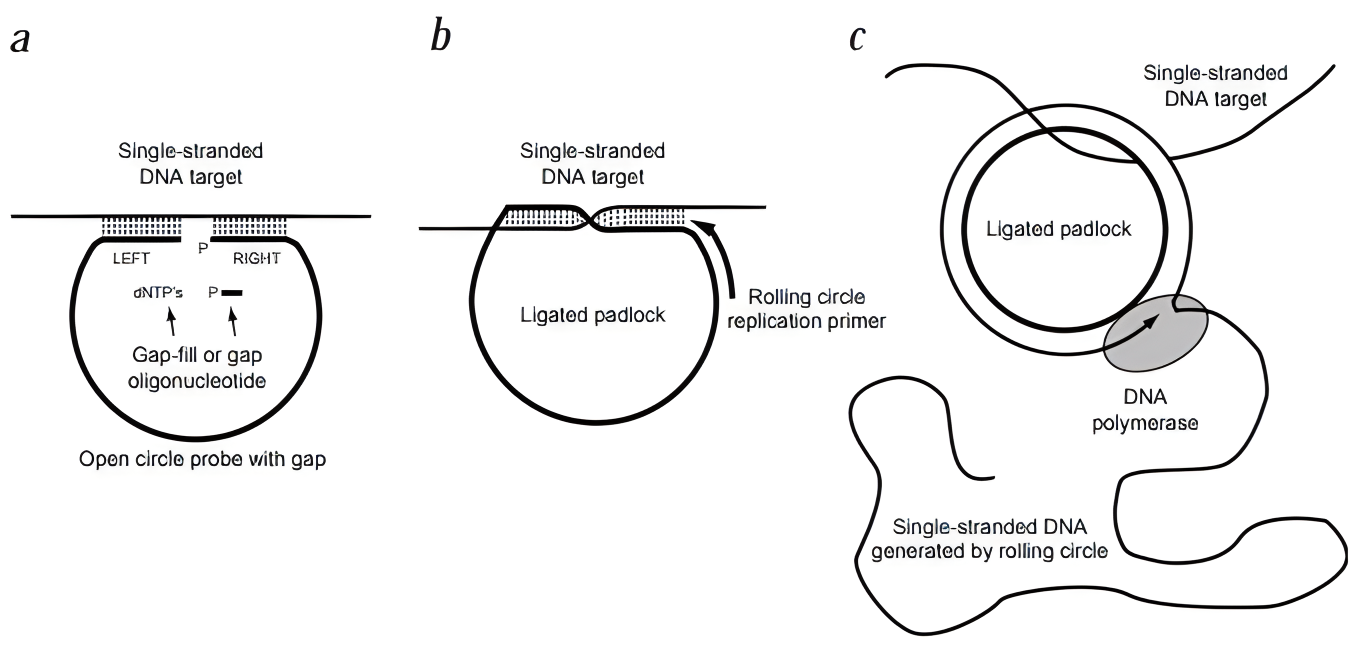
滚环扩增(RCA):于1998年被建立,模拟了自然界微生物环状DNA的滚环复制过程。RCA利用环状DNA模板和phi29 DNA聚合酶,将dNTPs转变成单链DNA,从而对靶核酸进行信号放大。RCA反应发生的关键在于构建一个完整的单链DNA环用于后续扩增,RCA成环方式包括粘性末端成环和平末端成环。滚环扩增技术有多种类型,包括线性扩增(单引物 RCA)、指数扩增、多引物扩增和信号扩增 RCA 等,不同类型的RCA在引物设计和扩增方式上有所不同,但都利用了滚环扩增的基本原理。 具体过程如下: 1. 模板准备:首先构建一个环状DNA模板,该模板包含目标序列的互补链。 2. 引物结合:在RCA反应体系中加入特异性引物,该引物与环状DNA模板上的特异区域结合。 3. 解链和合成:在phi29 DNA聚合酶的作用下,dNTPs被添加到引物上,以单链DNA为模板进行延伸。每次合成后,引物从新生成的双链中脱离,并重新与另一条单链结合继续合成。 4. 循环往复:随着反应的进行,单链DNA逐渐被替换成双链DNA,同时释放出大量的单链DNA片段。这些片段作为新的模板,继续引发新一轮的RCA反应。
RCA扩增原理示意图(来源:doi:10.1038/898 ) RCA技术的优势:
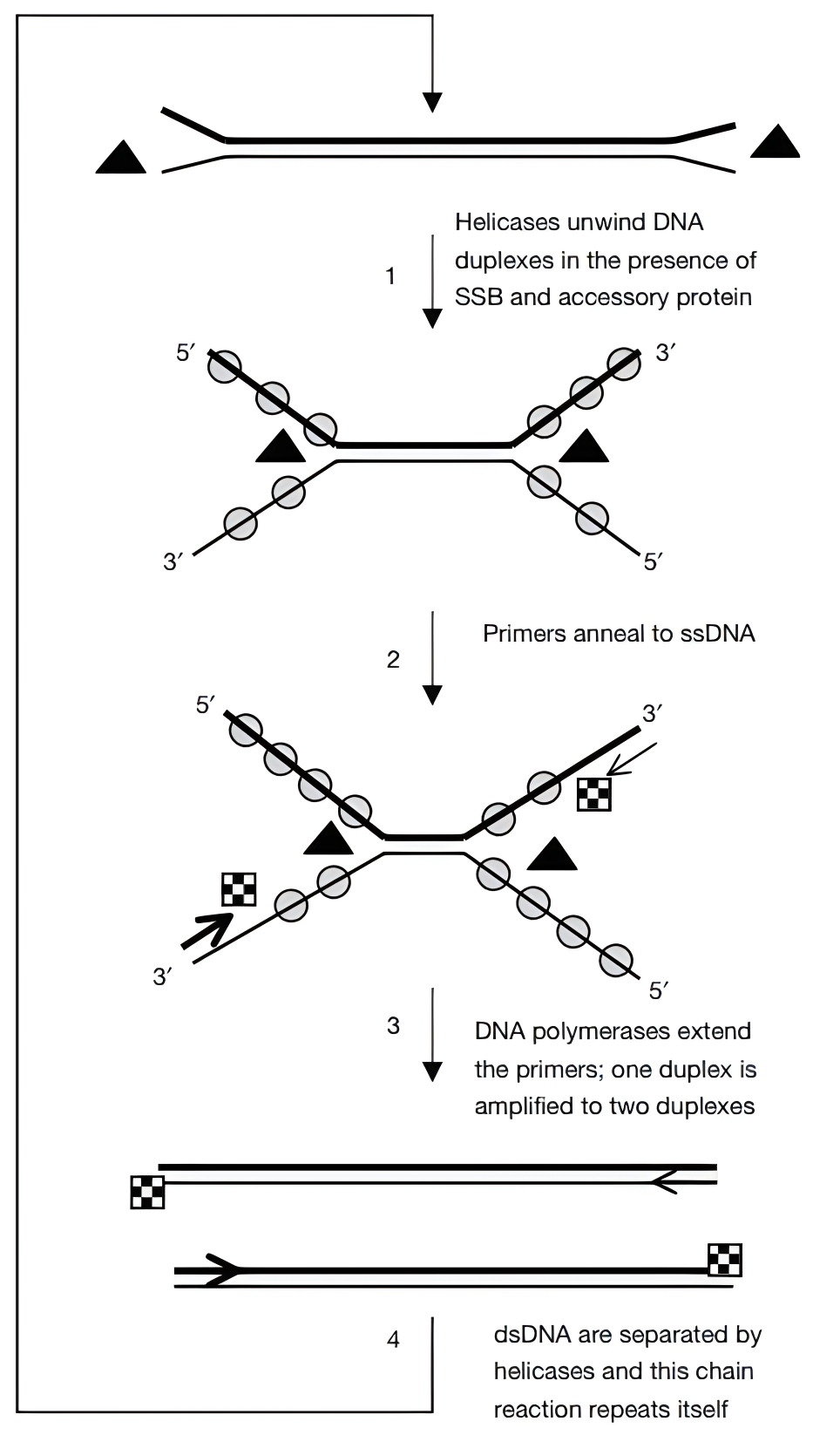
RCA 技术也存在一些局限性,例如可能受到环状模板的质量和纯度的影响,以及在某些情况下可能出现非特异性扩增等。但通过优化反应条件和引物设计等,可以在一定程度上减少这些问题的发生。 依赖解旋酶 DNA 等温扩增技术(HDA):美国 NEB 公司于 2004 年发明的一种新型核酸等温扩增技术。该技术模拟体内 DNA 复制的自然过程,利用解旋酶在恒温下解开 DNA 双链,再由 DNA 单链结合蛋白稳定已解开的单链为引物提供模板,然后在 DNA 聚合酶的作用下合成互补的双链,继而不断重复上述循环扩增过程,最终实现靶序列的指数式增长。 具体过程如下: 1. 模板选择:选择合适的DNA模板,确保其包含HDA反应所需的特定序列结构。 2. 引物设计:设计两组特异性引物,包括启动子和延伸子。启动子与模板DNA的特异区域结合,而延伸子则与模板DNA的另一特异区域结合。 3. 解旋作用:利用DNA分子的解旋酶活性,启动子和延伸子分别引发模板DNA双链的解开,形成单链状态。 4. 聚合反应:在单链状态下,DNA聚合酶可以连续添加dNTPs到打开的DNA链上,实现指数级扩增。 5. 自我循环:新合成的DNA片段与未完全解开的双链结合,继续作为模板进行新一轮的解旋和扩增。
HDA扩增原理示意图(来源:doi: 10.1038/sj.embor.7400200 ) HDA技术的优势:
HDA缺点:
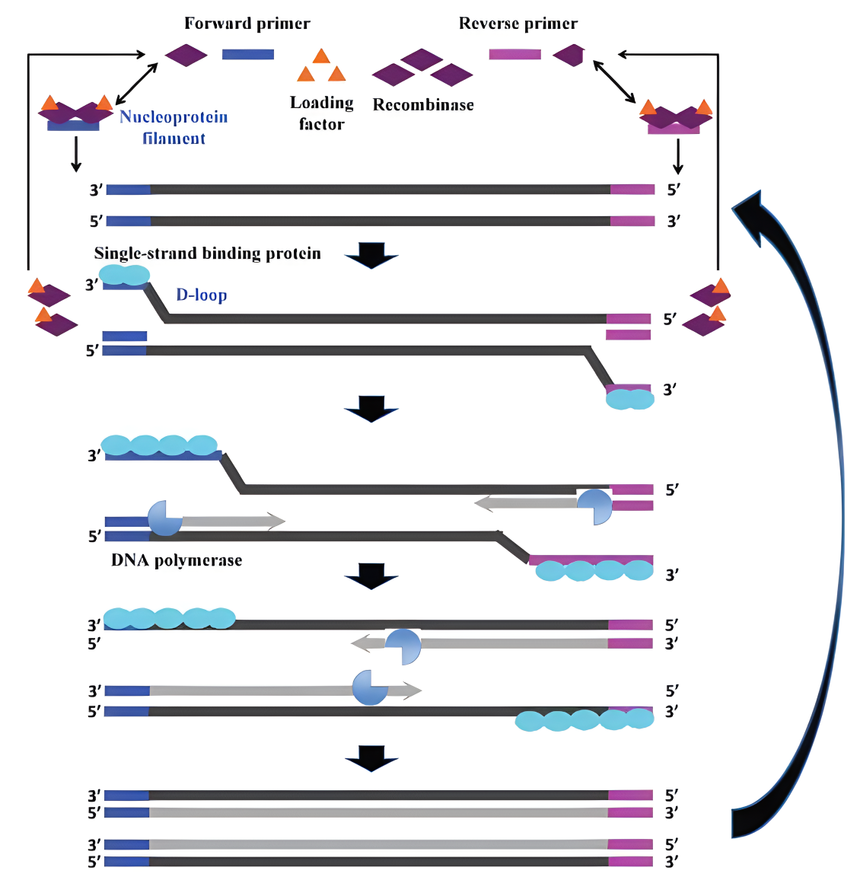
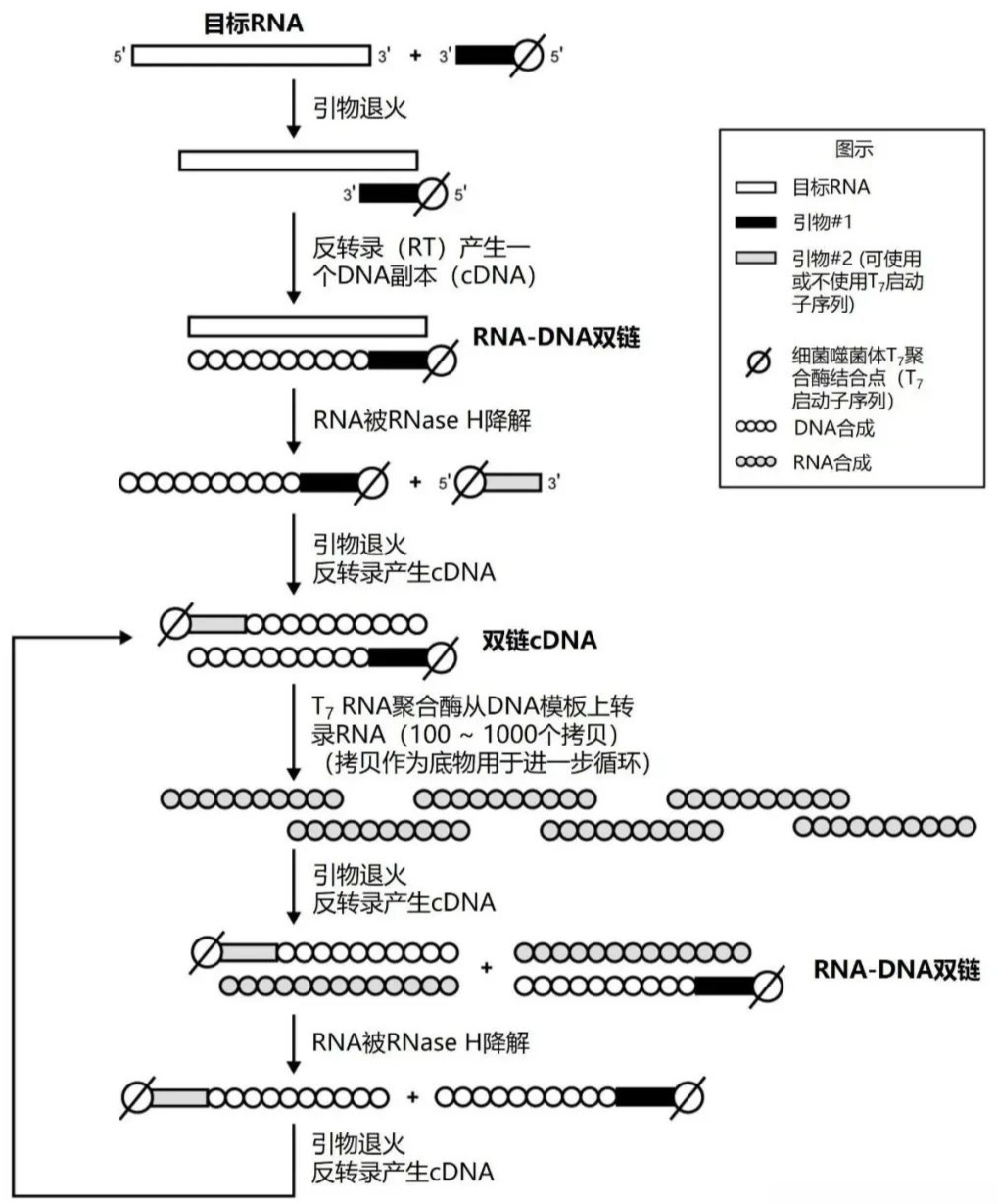
05 重组酶聚合酶扩增技术(RPA):是在2006年由Twist DX公司提出的等温扩增技术,被人们认可为一种“可替代PCR的技术”。目前,重组酶等温扩增技术包括RPA和RAA 2种技术,其不同之处在于RAA是细菌或真菌中获得的重组酶来替代RPA技术中较难获得的噬菌体重组酶,两者整个扩增过程一致。RAA作为一种新型的具有我国自主知识产权的等温核酸扩增技术。重组酶等温扩增反应体系主要由重组酶(T4 UvsX)、单链DNA结合蛋白(T4 Gp32)和链置换DNA聚合酶(Bsu)等多种酶组成。 1、技术原理 RPA技术主要依赖于三种酶和蛋白的协同作用。 重组酶:能够结合单链核酸(如寡核苷酸引物),形成重组酶-引物复合体。这种复合体在双链DNA模板中扫描并识别与引物同源的靶序列。 单链结合蛋白(SSB):当引物定位到同源序列后,重组酶解开双链结构,促使引物与模板进行链交换,形成D环结构。此时,单链结合蛋白结合到被置换出的单链DNA上,稳定D环结构,防止其重新结合成双链。 链置换DNA聚合酶:在ATP水解提供能量的条件下,重组酶解离暴露出引物的3'端,DNA聚合酶(如Bsu DNA polymerase)结合至引物上,启动DNA的扩增。DNA聚合酶在延伸过程中,会置换出下游的DNA单链,这些单链再与单链结合蛋白结合,稳定单链结构。
RPA 的作用原理示意图(来源:doi:10.1039/c8an01621f) 2、扩增过程 复合体形成:在ATP参与下,重组酶分别与上、下游引物结合形成重组酶-引物复合体。 靶序列识别:该复合体扫描双链DNA模板,并识别与引物同源的靶序列。 链交换与D环形成:定位至同源靶序列后,重组酶解开双链结构,并促使引物与模板进行链交换,形成D环结构。 DNA聚合:ATP水解改变重组酶-引物复合体构象,重组酶解离暴露出引物的3'端,DNA聚合酶结合至引物上,启动DNA扩增。 循环扩增:DNA聚合酶在延伸过程中置换出下游的DNA单链,这些单链再与单链结合蛋白结合,稳定单链结构。同时,上、下游引物同步反应,不断重复上述过程,最终形成大量的扩增子。
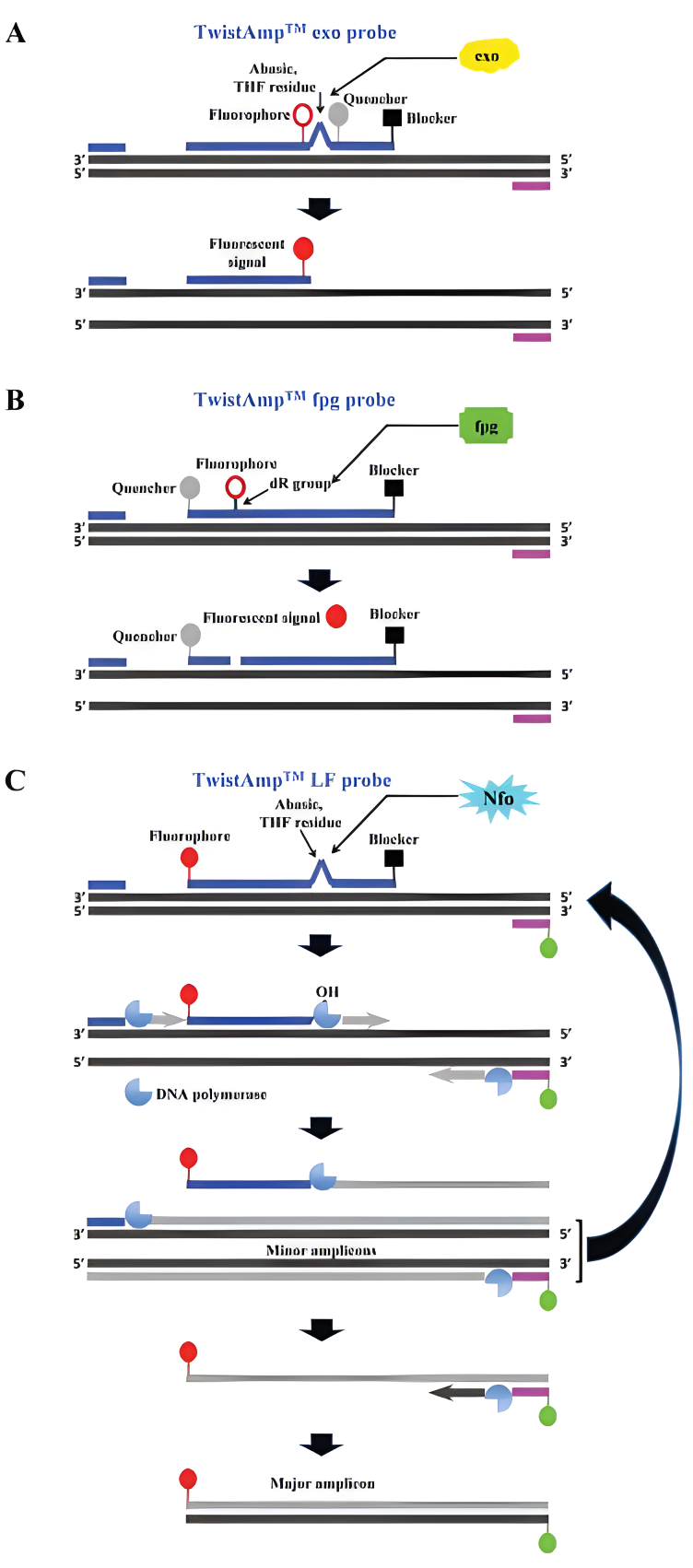
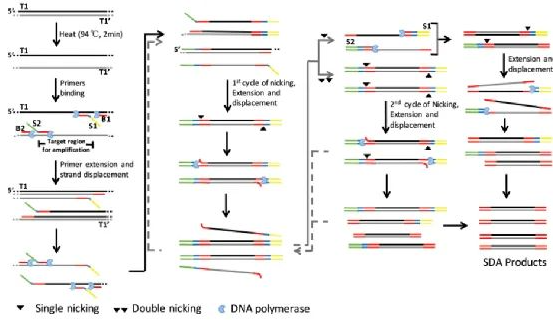
TwistAmp™ probe原理示意图(来源:doi:10.1039/c8an01621f) 3、技术特点 多酶协作:RPA为多酶反应体系,需多个酶的协作才能完成扩增。 等温扩增:RPA可在25~42℃范围内进行反应,无需热循环,最适反应温度为37℃左右。 快速高效:RPA反应速度快,一般可在5~30分钟内达到检出水平,适用于POCT领域。 灵敏度高:RPA技术可检测低至单拷贝的核酸模板。 应用广泛:RPA技术可用于不同种类的目标生物检测,样本耐受性高,可广泛覆盖疫病防控、医学诊断、食品安全、环境卫生、农业病害、动物健康、生物制品质控等领域。 RPA技术作为新型重组酶等温扩增技术,仍存在部分缺点。如重组酶等温扩增技术分析易受多种因素影响。内因主要包括酶活性、引物探针设计等,外因主要包括产物检测前处理、反应温度和假阴性问题等。此外,固定反应体系和较高试剂成本也影响其普适性。 4、实际应用 RPA技术已被广泛应用于核酸检测领域,特别是在基层和现场即时检测中展现出巨大的应用潜力。此外,RPA技术还可与其他技术结合使用,如结合荧光探针和核酸酶进行实时检测,或结合侧向层析技术实现可视化检测等。 06 依赖核酸序列的扩增(NASBA):是一项以RNA模板进行等温核酸扩增并能实时观测结果的检测方法。该技术的检测反应有赖于AMV逆转录酶、噬菌体T7 RNA多聚酶、核糖核酸酶H、两种特别设计的特异性寡核苷酸引物和分子信标探针共同协作而完成。它是一种由一对引物介导的、连续均一的、体外特异核苷酸序列等温扩增的酶促反应过程。反应在 42℃进行,可在 2 小时左右将模板 RNA 扩增约 109~1012 倍,且不需特殊的仪器。 NASBA 的简要过程如下: 1. RNA 模板链进入反应混合物后,第一个引物首先与模板链的 3'端结合; 2. 反转录酶合成反义的互补DNA链; 3. RNA 酶H分解破坏RNA模板链; 4. 第二个引物与DNA的5’端结合; 5. T7 RNA polymerase合成RNA补偿链,并加入到步骤1中,使反应可以循环进行。 NASBA反应示意图(来源:知乎@诊断科学) 标准的NASBA反应体系中含有T7 RNA聚合酶、RNAse H、禽骨髓白血病病毒(AMV)逆转录酶、核糖核苷三磷酸(NTP)、脱氧核糖核苷三磷酸(dNTP)、一对特殊引物及各种反应缓冲液等。引物P1长约45个碱基,其 3’末端大约20个碱基对与模板的 3’末端互补,5’末端含有能被T7噬菌体 RNA 聚合酶识别的启动子序列;引物P2大约20个碱基长,其序列与模板的 5’末端一致。AMV 的作用是以单链RNA为模板合成互补的cDNA 及以cDNA为模板合成双链 DNA。RNAse H在体系中的作用是将RNA-cDNA杂合分子中的RNA降解,T7 噬菌体RNA聚合酶则是识别双链DNA中的启动子区,催化DNA转录为RNA。 NASBA 产物的检测方法主要有以下两种: 1. 直接检测:将反应产物直接在琼脂糖甲醛变性凝胶上电泳,用EB(溴化乙锭)染色,在紫外灯下观察单链 RNA 片段的长度。该方法只能初步检测反应产物,如需进一步鉴定还需结合其他检测方法,如Northern blot、限制性酶内切位点分析等。 2. 寡核苷酸检测:将NASBA技术和ELIS(酶联免疫吸附剂测定)方法相结合,其原理与电化学发光检测类似。通过将与检测信号有关的物质标记在核酸探针上,检测该信号从而间接检测 RNA。不同的是核酸探针上是用地高辛(Digoxygenin,DIG)标记的,通过探针捕获将地高辛标记的探针和 NASBA 产物的复合物吸附到微量反应板上,作用于底物硝基苯基磷酸盐显色,然后通过分析吸光度来检测RNA产物。该方法需要使用酶标仪。 NASBA的应用: NASBA具有操作简单、特异性强、灵敏度高、不易被污染等优点,已广泛应用于病毒、细菌、霉菌、寄生虫和细胞因子等的检测,特别是用于艾滋病病毒、丙肝肝炎病毒等 RNA 病毒的检测当中。美国FDA批准NASBA数字化芯片技术用于艾滋病毒 RNA的快速检测。中国国家质量监督检验检疫总局 将NASBA方法设为早期筛查禽流感病毒标准方法之 一(GB/T19440-2004)。韩国kainos公司也研发全自动 便携式NASBA检测仪,使得NASBA更适于疫情现场 快速诊断。 07 链替代扩增(SDA):最早于 1992 年由 Walker 等人在《美国国家科学院汇刊》中介绍,这是一种基于酶促反应的 DNA 体外等温扩增技术。SDA 主要利用限制性内切酶剪切 DNA 识别位点的能力和 DNA 聚合酶在切口处向 3′延伸并置换下游序列的能力,在等温条件下进行扩增。整个过程由准备单链 DNA 模板、生成两端带酶切位点的目的 DNA 片段、SDA 循环扩增 3 个步骤组成。 其具体原理如下: 首先,含有目标特异性区域和半修饰限制性酶位点的引物与 DNA 聚合酶结合,生成含有限制性酶位点的合成双链 DNA(dsDNA); 然后,一种限制性酶在 dsDNA 的两条链中的一条上产生一个特定位点的“缺口”;一旦链被切开,DNA 聚合酶就会在缺口部位的 3′端开始合成,创造出一条新的 DNA 链。由于所使用的 DNA 聚合酶缺乏 5′到 3′的外切酶活性,它在聚合新链时不会破坏现有的链,只是置换了下游的非模板链; 接着,每条被置换的链都可以与更多的引物退火,这个过程继续进行,新形成的 DNA 链被反复切断、延伸和置换,从而导致原始 DNA 目标的指数式扩增。
第一代SDA技术原理示意图(来源:网络)
第二代SDA技术原理示意图(来源:网络) SDA 技术优缺点: SDA 技术具有一些优点,例如在等温条件下进行,不需要复杂的温度循环设备;具有较高的扩增效率等。然而,它也存在一些局限性,比如可能受到反应成分、扩增时间和模板 DNA 浓度等因素的影响,导致非特异性扩增产物的累积,需要优化扩增条件以减少非特异性扩增。此外,该技术的反应成分相对复杂,成本较高。在实际应用中,需要根据具体需求和实验条件,综合考虑其优缺点来选择使用。 |